|
|
|||||||
|
|
||||||||
| 高等学校 化学I 私立開成高等学校 内川章 |
「酸・塩基・中和」 学習指導要領との対応:
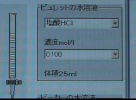
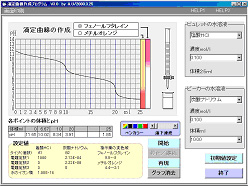
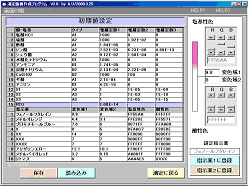
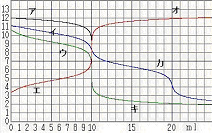
課題シート 「滴定曲線」プログラムの実習 組 番 氏名 ○操作については,操作マニュアル参照のこと ○「初期値設定画面」での変更データは保存しないこと 1.滴定曲線と指示薬 以下の酸・塩基の組み合わせで滴定曲線を作成する。 指示薬の変色により,中和点を知ることができることを確かめる。 ア.NaOH + HCl イ.Na2CO3 + HCl ウ.NH3 + HCl エ.CH3COOH + NaOH オ.H2SO4 + NaOH ◆前者をビーカーに,後者をビュレットにとる。 濃度は0.1mol/l,ビーカー側の体積は10.0ml ,指示薬はMOまたはPPとする。 2.酸・塩基の濃度とpHの関係 酸または塩基を濃度を変えてビーカーに入れ,スタートのpHを読みとる。
酢酸(濃度0.1mol/l)の電離定数を適当に変え,スタートのpHを読みとる。
4.指示薬の変色域 架空の指示薬Xの変色域,酸性色,塩基性色を決め, 指示薬1.2に登録して, 3のどれかを滴定してみる。結果を作図する。
|
||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||